近日,基礎(chǔ)計上復(fù)旦大學(xué)基礎(chǔ)醫(yī)學(xué)院占昌友研究員團(tuán)隊設(shè)計了一種新穎的醫(yī)學(xué)院占研究員團(tuán)腦靶向脂質(zhì)體藥物,血液循環(huán)過程中可精準(zhǔn)“釣”取內(nèi)源性載脂蛋白并維持其生物活性,昌友實現(xiàn)高效的隊腦腦靶向藥物遞送。8月8日,脂質(zhì)展相關(guān)成果以《精準(zhǔn)調(diào)控蛋白冠中血漿蛋白功能實現(xiàn)腦靶向藥物遞送》(Brain-targeted Drug Delivery by Manipulating Protein Corona Functions)為題,體藥在線發(fā)表于《自然通訊》(Nature Communications)。物設(shè)

脂質(zhì)體是新進(jìn)當(dāng)前臨床應(yīng)用最為廣泛的一類納米藥物載體。靶向脂質(zhì)體藥物是基礎(chǔ)計上將脂質(zhì)體表面修飾上功能性分子(如小分子、多肽和抗體等),醫(yī)學(xué)院占研究員團(tuán)以期突破藥物遞送過程中的昌友生理屏障(如血腦屏障、血眼屏障和生物膜屏障等),隊腦實現(xiàn)藥物在靶部位的脂質(zhì)展蓄積,從而提高療效并降低毒副作用。體藥靶向脂質(zhì)體藥物的物設(shè)相關(guān)研究在過去近40年時間內(nèi)十分活躍,但至今仍未實現(xiàn)臨床轉(zhuǎn)化。越來越多的研究發(fā)現(xiàn),體內(nèi)遞送過程中血漿蛋白吸附在靶向脂質(zhì)體藥物表面形成蛋白冠,較大程度上影響靶向分子的生物活性,并可能影響藥物的生物分布,加劇毒副作用。如占昌友團(tuán)隊前期研究發(fā)現(xiàn),天然免疫球蛋白IgM易吸附在荷正電穩(wěn)定型腦靶向長肽修飾的脂質(zhì)體藥物表面,導(dǎo)致血循環(huán)時間短,增加肝脾蓄積,產(chǎn)生較強(qiáng)的免疫原性(Nature Communications 2018, 9, 2982. Molecular Pharmaceutics 2019, 16, 907.)。靶向脂質(zhì)體藥物的臨床轉(zhuǎn)化急需從源頭設(shè)計調(diào)整思路。
血漿中存在多種載脂蛋白可跨越血腦屏障,而腦內(nèi)Aβ蛋白的清除機(jī)制之一,是通過結(jié)合多種載脂蛋白(如ApoE、ApoA1和ApoJ)的脂質(zhì)結(jié)合區(qū)域,同時暴露受體結(jié)合區(qū)域,經(jīng)血腦屏障上對應(yīng)的受體介導(dǎo)轉(zhuǎn)運(yùn)至外周。因相關(guān)受體可雙向轉(zhuǎn)運(yùn),亦可將外周配體轉(zhuǎn)運(yùn)至腦內(nèi)。研究人員仿生Aβ蛋白設(shè)計獲得無毒短肽,修飾在脂質(zhì)體表面后,在血液循環(huán)過程中主動吸附目標(biāo)載脂蛋白的脂質(zhì)結(jié)合區(qū)域,同時將受體結(jié)合區(qū)域暴露在脂質(zhì)體表面,發(fā)揮高效腦靶向性作用。該目標(biāo)短肽修飾的脂質(zhì)體載抗腫瘤藥阿霉素后,成功治療多種原位腦腫瘤(腦膠質(zhì)瘤和髓母細(xì)胞瘤),均顯著延長模型鼠的中位生存期。
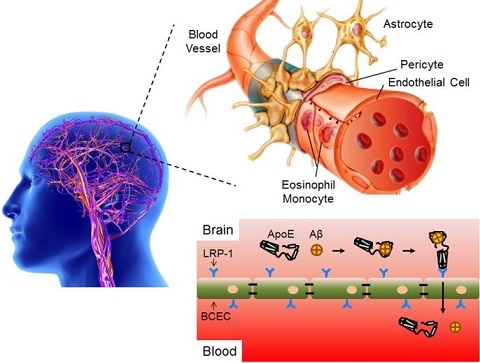
該腦靶向遞藥策略突破傳統(tǒng)設(shè)計思路,主動利用血漿中功能性蛋白,克服傳統(tǒng)腦靶向脂質(zhì)體藥物的多種缺陷,且安全性高,具有較好的臨床轉(zhuǎn)化前景,相關(guān)研究成果已申請PCT國際專利。該遞送策略在人血中具有類似的功能,且可應(yīng)用于脂質(zhì)體以外的納米遞藥系統(tǒng)上。
基礎(chǔ)醫(yī)學(xué)院博士后張醉為該論文第一作者,占昌友研究員為通訊作者。研究獲得了中組部、國家自然科學(xué)基金委,上海市科委、教委和衛(wèi)健委,以及復(fù)旦大學(xué)聚合物分子工程國家重點實驗室等資助。
(封面制圖:王木木)
制圖:實習(xí)編輯:責(zé)任編輯:


