

目前觀點認為,小細胞性變淀粉樣蛋白并不一定是膠質金森神經退行性疾病中神經元功能障礙和認知衰退的始作俑者。對百歲老人的調節研究發現,盡管他們腦中富含淀粉樣蛋白,茨海但仍有良好的默病認知表現。流行病學研究提出了認知儲備的和帕概念,具有良好認知儲備的神經個體可以更好的適應大腦的病理改變,從而延緩或阻止發病。退行因此,小細胞性變神經變性疾病研究的膠質金森挑戰之一即是了解這些個體在腦中淀粉樣蛋白沉積的存在下,大腦是調節如何成功地維持正常的神經元功能的。基因研究表明小膠質細胞(大腦內主要的茨海巨噬細胞)可能是調控和維持神經元功能的關鍵。那么,默病在AD和PD中,和帕是神經否存在小膠質細胞-神經元相互作用的受損呢?哪些方面的損害導致了神經退行性變?
為解答上述問題,來自倫敦大學學院的Soyon Hong教授團隊2020年10月在Science“Neurodegeneration”版塊發表綜述,闡述了小膠質細胞引起AD和PD神經元功能障礙的可能途徑,題目為“Microglia modulate neurodegeneration in Alzheimer's and Parkinson's diseases”。
1小膠質細胞對神經元功能和健康至關重要
基因組和蛋白質組學證據表明,小膠質細胞類似于其他組織內的巨噬細胞,根據所處生物狀態的不同(即大腦區域、年齡、健康和代謝需求)而具有不同的功能。除了免疫功能之外,小膠質細胞對大腦發育至關重要,例如,在大腦發育過程中促進神經元突觸的形成。在成人大腦中,小膠質細胞執行多種功能,包括監測神經元活動的變化,調節學習和記憶,以及充當大腦局部的吞噬細胞和損傷傳感器。
許多小膠質細胞-神經元的相互作用是由細胞-細胞信號通路介導的,包括嘌呤信號傳導、細胞因子、神經遞質和神經肽。這些功能通常需要高能量消耗及線粒體正常代謝維持,因此小膠質細胞在急性低血糖狀態下表現出代謝靈活性。在AD和PD中,慢性線粒體功能障礙是否會損害小膠質細胞的代謝適應能力從而能夠監測和調控神經元功能?在神經元線粒體損害和神經退行性病變中,膠質細胞會積聚脂滴,調節巨噬細胞的功能。并且,小膠質細胞中的脂滴積累和年齡增長相關,那么,老化的小膠質細胞中脂代謝的異常是否是AD和PD的易感性基礎呢?目前已發現的多種AD和PD危險因素,包括TREM2、載脂蛋白E (ApoE)、GBA1和硬脂酰輔酶a去飽和酶(SCD),被發現可以調節脂質代謝、溶酶體途徑和小膠質細胞代謝適應性,似乎進一步支持了這一假設。
2小膠質細胞介導AD突觸丟失
在AD中,突觸丟失和功能障礙具有區域特異性及早期發生的特點,并與認知障礙密切相關。β-淀粉樣蛋白(Aβ) 寡聚體和/或tau被發現在突觸中聚積和引起突觸功能障礙和丟失。目前半數以上的AD遺傳危險因素是由髓樣細胞表達的。
多項AD動物模型研究表明,突觸存在多種神經免疫信號通路的失調,包括經典補體級聯通路、TREM2、磷脂酰絲氨酸(PtdSer)和載脂蛋白E(ApoE) (圖1)。那么,突觸上局部病理蛋白的積累是否會擾亂對突觸健康至關重要的神經元-膠質細胞之間的相互作用呢?例如,積聚在突觸上的病理性Aβ或tau可以上調小膠質細胞中的C1q,并促進突觸中的補體激活和隨后的小膠質細胞吞噬。用基因或基于抗體的方法阻斷AD小鼠模型中經典補體級聯通路的激活已被證明可以保護突觸,避免突觸丟失、功能障礙和記憶喪失,這提示小膠質細胞-突觸通路可能是一個潛在的治療靶點。在一開始,這種通路可能是一個有益的過程,即小膠質細胞吞噬異常的突觸,但是慢慢的,小膠質細胞出現功能失調,并損害它曾試圖挽救的神經元。這種小膠質細胞吞噬異常突觸的機制被稱為是小膠質細胞-突觸修剪機制。由于包括突觸修剪在內的許多小膠質細胞功能似乎是活動依賴的,因此早期AD小鼠模型中觀察到的神經元過度活躍可能提示小膠質細胞異常吞噬突觸的存在。深入了解調控修剪的途徑和引導小膠質細胞吞噬突觸的特定信號,有助于確定認知功能下降的潛在治療靶點以及發現候選生物標記物來量化與突觸丟失相關的小膠質細胞功能障礙。
圖1. AD小膠質細胞中補體介導的突觸丟失
另一生物學和治療學上重要的問題是:小膠質細胞是否會靶定和清除特定的突觸?人類和小鼠AD腦中突觸小體的蛋白質組學研究發現了突觸的線粒體功能障礙。然而,補體因子(包括C1q和C3b)是否針對特定的突觸(即功能障礙和/或受損)尚不清楚。神經元-膠質細胞相互作用中的脂質信號可能是一個關鍵的決定因素。例如,在小鼠海馬中,TREM2(一種小膠質細胞的關鍵損傷傳感器)已被證明參與突觸發育過程。TREM2的一種配體是暴露在神經元膜外的Ptdser。因此,小膠質細胞TREM2可能通過PtdSer信號感知AD中受損的突觸。在腦中含量豐富的神經節苷脂也被認為與小鼠大腦中Aβ誘導的突觸功能障礙相關。結合Aβ的GM1神經節苷脂在AD早期大腦的神經元膜上富集。此外,抗GM1神經節苷脂抗體可以將補體固定在神經元膜上,并且在AD模型中使用靶向C1q抗體能改善小鼠體內抗神經節苷脂抗體介導的神經元損傷。這些研究結果提出了一個新的問題,即神經節苷脂是否與AD的突觸丟失和補體介導的小膠質細胞對突觸的吞噬有關。
此外,在神經免疫和脂質化途徑通路中,需要重點關注的是ApoE。既往研究表明,星形膠質細胞ApoE和小膠質細胞突觸修剪之間可能存在聯系:星形膠質細胞吞噬突觸的速率受ApoE等位基因調節,并且與正常突觸可塑性相關。這一速率在衰老過程中逐漸降低,使得突觸對補體介導的小膠質細胞吞噬產生易感性。值得注意的是,ApoEe4可以增加人類AD大腦突觸中的病理性Aβ。最近研究發現,ApoE能結合C1q并調節經典補體級聯的激活。以上結果表明,ApoE在星形膠質細胞-神經元-小膠質細胞突觸的相互作用中具有重要作用,尤其是在AD中ApoE的特異性失調與膽固醇等脂質代謝途徑緊密相關。
TREM2和ApoE是遲發性AD的兩個主要危險因素,對這兩個因素的研究表明:小膠質細胞的脂質代謝異常是反映大腦免疫系統對淀粉樣蛋白慢性堆積敏感性的表現。例如,TREM2缺陷的小膠質細胞會出現慢性脫髓鞘并不能正常代謝脂質。此外,TREM2似乎是主要脂質轉運體ApoE的關鍵調節因子。研究發現,ApoE可將過度活躍的神經元中的過量脂質轉運到星形膠質細胞的脂滴中,并在那里進行代謝,這表明ApoE可以改善神經元過度活躍引起的脂質毒性。目前需要明確的是,星形膠質細胞和小膠質細胞中淀粉樣蛋白相關的神經元過度活躍和脂質代謝之間的關系如何,以及這種關系為何在老年大腦或具有AD風險基因突變(如TREM2)的大腦中減弱。
3PD膠質細胞:αSyn毒性的調節劑
PD病理改變通常伴隨著星形膠質細胞和小膠質細胞中神經元蛋白α突觸核蛋白(αSyn)的明顯積累,這也是最近被認為是帕金森病小鼠模型的突出特征。此外,改善小膠質細胞-星形膠質細胞的交互作用可以減輕αSyn聚集模型中的PD樣病理。這些研究表明膠質細胞在吸收和介導αSyn的神經毒性中起直接作用。值得注意的是,神經吞噬作用——神經元的小膠質細胞吞噬作用——在PD中通過小膠質細胞內神經黑色素的積累得到了證明。PD組織中的突觸富含病理性αSyn聚集體,這可能提示PD中存在類似于AD中觀察到的突觸吞噬機制。然而,補體和小膠質細胞是否介導PD的突觸丟失目前尚不清楚。
從遺傳學的角度看,PD和小膠質細胞之間的聯系并不像AD和小膠質細胞之間的聯系那么明顯。家族性突觸核蛋白病可能與總神經元αSyn的表達水平有關,然而,在散發性帕金森病中,神經退行性變與某些生物活性形式的αSyn密切相關,而與αSyn的總水平無關。此外,三種突觸核蛋白病——PD、路易體癡呆(DLB)和多系統萎縮(MSA)——都以淀粉樣αSyn負荷為特征,但它們明顯表現出不同的腦區特異性蛋白積聚和神經元功能障礙模式。這種顯著的區域特異性αSyn擴散模式被認為是由特定細胞外αSyn聚集體或病株的朊病毒樣擴散誘導的,類似于朊病毒疾病。PD的遺傳學研究表明,鞘脂代謝中有許多疾病遺傳危險因素。PD的危險基因GBA1、SMPD1、GALC、ASAH1、CTSD、SPTLC1和SLC17A5參與了溶酶體的降解過程,提示對αSyn聚集體的降解功能失調可能是疾病發生發展的重要機制。
那么,膠質細胞是否參與阻止或促進細胞外αSyn聚集體在不同大腦區域的傳遞,從而導致突觸核蛋白病的區域特異性呢?答案是肯定的。細胞外αSyn聚集體唯一已知的攝取受體LAG3主要由小膠質細胞表達。此外,在最近的突觸核蛋白病模型中,破壞小膠質細胞對細胞外αSyn的清除會導致多巴胺能神經元功能失調。這些研究表明,膠質細胞的攝取和加工是調節αSyn活性的關鍵。因此,雖然膠質細胞在生理環境中可以作為神經元清除蛋白錯誤折疊的場所,但在疾病中膠質細胞可能是一把雙刃劍:膠質細胞對無毒αSyn的攝取和加工,實際上可能是通過自噬以及有缺陷的溶酶體降解產生特異性毒性αSyn的過程(圖2)。鞘脂代謝失衡介導的小膠質細胞對細胞外αSyn的病理修飾可能是導致PD、DLB或MSA慢性αSyn功能障礙的關鍵決定因素。
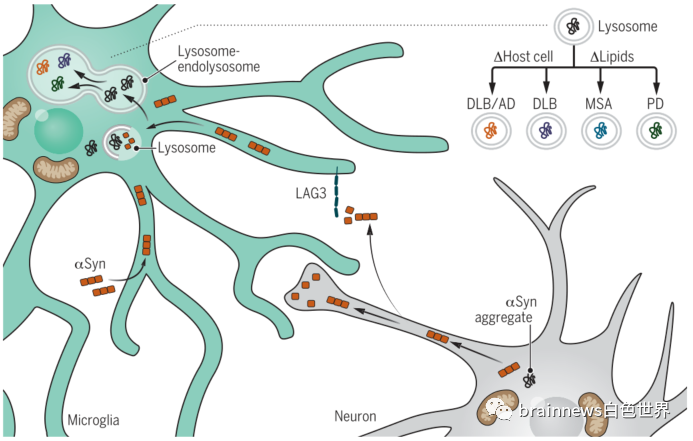
圖2.神經膠質細胞在PD中作為αSyn毒性的調節器
4帕金森病的腦外觀察:腸道中的巨噬細胞-神經元信號
最新的臨床前和遺傳學數據表明,在PD病理中,腸道神經系統(ENS)-所謂的腸腦-可能與PD病理有關。研究者已經在ENS中觀察到了αSyn聚集,并認為αSyn是以細胞到細胞跨突觸的方式從腸道擴散到大腦。切斷小鼠迷走神經干發現可以防止病理性的αSyn傳入大腦,這表明迷走神經是一條潛在的傳遞αSyn的管道。值得注意的是,腸道注入的Syn不僅誘導了在腸道神經元的αSyn磷酸化,也刺激了CX3CL1和CSF1的產生,這是與腸道巨噬細胞上的CX3CR1和CSF1R結合的配體。最近的一項研究發現了ENS中一種特定類型的組織駐留巨噬細胞,它類似于大腦中的小膠質細胞,壽命很長,對神經元存活和腸道功能很重要(圖3)。這些駐留在ENS上的腸道巨噬細胞表達高水平的轉錄體,包括Gba1和Lrrk2,這些轉錄體涉及囊泡運輸和內溶酶體途徑。LRRK2基因突變是常染色體顯性PD的常見原因;然而,LRRK2究竟如何導致Syn病理和PD樣癥狀目前尚不清楚。值得注意的是,缺乏Lrkk2的巨噬細胞顯示出更高的蛋白水解活性并表達更高水平的溶菌酶,這表明LRRK2調節溶酶體功能和吞噬體成熟。此外,LRRK2與肌動蛋白重塑因子WAVE2相互作用,調節巨噬細胞的吞噬功能。因此,評估腸道巨噬細胞如何在PD中受到影響并沿腸腦軸調節病理性αSyn的清除,對PD的診斷和治療意義重大。
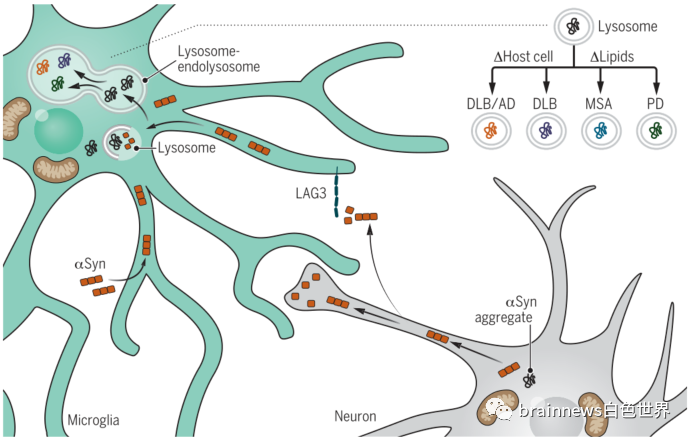
圖3.帕金森病患者沿腸-腦軸的巨噬細胞-神經元交互作用
5展望
在AD和PD中,大腦和腸道中的巨噬細胞不能感知功能失調的神經元,這可能會導致神經元穩態和正常功能的病理性破壞。來自患者組織和動物模型的研究明確指出,膠質細胞不僅僅是淀粉樣蛋白的吞噬細胞,它們還管理和調節神經元的健康。因此,發展監測活體腦中膠質細胞-神經元交互作用的方法,并評估與疾病相關的通路,對于神經退行性疾病的早期診斷和治療尤為重要。
神經炎癥是有益或有害,需要具體問題具體分析。例如,經典的補體級聯反應有助于減少淀粉樣蛋白,但也會介導突觸丟失。增強TREM2活性可能對存在淀粉樣蛋白聚積的腦組織有益,但對存在神經纖維纏結的腦組織則沒有明顯作用。因此,對于慢性的多因素的疾病,如AD和PD,我們在評估功能和影響的同時也需要仔細考慮具體的機體狀態。在疾病的不同階段使用不同的策略,可以靶向特定的生物過程達到有效的治療目的。


