腫瘤免疫治療作為近些年迅速發(fā)展起來(lái)的陽(yáng)心腫瘤治療新方法,通過(guò)調(diào)動(dòng)機(jī)體自身的彭華免疫系統(tǒng)來(lái)對(duì)抗腫瘤,使得腫瘤治療的合作局面煥然一新。特別是新代性免疫檢查點(diǎn)阻斷治療,造福了大量的腫瘤癌癥患者,其發(fā)現(xiàn)者們也因此于2018年獲得了諾貝爾生理醫(yī)學(xué)獎(jiǎng)。特異盡管如此,陽(yáng)心免疫檢查點(diǎn)阻斷治療還存在著應(yīng)答率低、彭華腫瘤復(fù)發(fā)等問(wèn)題,合作因此仍需更多更有效的新代性免疫治療手段。

細(xì)胞因子作為機(jī)體免疫調(diào)控網(wǎng)路中的腫瘤重要分子,在機(jī)體抗腫瘤反應(yīng)中也具有非常重要的特異影響。其中,陽(yáng)心白細(xì)胞介素15(IL-15)能夠有效地促進(jìn)效應(yīng)細(xì)胞,彭華包括效應(yīng)CD8+T細(xì)胞和NK細(xì)胞的合作增殖和胞毒作用,因而在抗腫瘤治療中具有很大的潛力。但是IL-15在循環(huán)系統(tǒng)給藥治療過(guò)程中,常伴隨著嚴(yán)重的毒副作用,大大限制了IL-15在臨床上的應(yīng)用。
因此,尋找到有效的修飾或改造方法使得IL-15能夠安全有效地發(fā)揮抗腫瘤功能是解決IL-15應(yīng)用困境的關(guān)鍵。針對(duì)這個(gè)問(wèn)題,基本的改造策略是:在外周組織限制IL-15的活性以避免嚴(yán)重的毒性,而選擇性地在腫瘤組織釋放出IL-15的活性以發(fā)揮有效的抗腫瘤作用。
中科院生物物理所彭華研究組之前提出的"pro-cytokine"前藥策略能夠有效地降低毒性(Cell Res, 2021)。
近日,清華大學(xué)醫(yī)學(xué)院傅陽(yáng)心教授團(tuán)隊(duì)與中科院生物物理所彭華研究員團(tuán)隊(duì)合作,在 Journal of Experimental Medicine 期刊發(fā)表了題為:An engineered concealed IL-15-R elicits tumor-specific CD8+T cell responses through PD-1-cis delivery 的研究論文。
該研究提出了不同于"pro-cytokine"的另一種全新的改造策略,根據(jù)對(duì)IL-15及其受體相互作用的結(jié)構(gòu)分析,將IL-15置于抗體Fc的羧基端,形成空間位阻,使Fc物理性地阻礙IL-15與受體的結(jié)合,有效降低IL-15的活性。在給小鼠腹腔注射時(shí),IL-15的毒性顯著降低,保證了IL-15使用的安全性。

為了確保遮蓋的IL-15能夠有效地激活腫瘤內(nèi)的效應(yīng)細(xì)胞而發(fā)揮抗腫瘤作用,研究人員加入了PD-1抗體(aPD-1),構(gòu)建出aPD-1-IL-15融合蛋白。在系統(tǒng)給藥時(shí),aPD-1抗體一方面能夠靶向到腫瘤組織,將IL-15更多地帶到腫瘤部位;另一方面,aPD-1抗體能夠?qū)⒄谏w的IL-15錨定在瘤內(nèi)高表達(dá)PD-1分子的效應(yīng)細(xì)胞,特別是PD-1+CD8+T細(xì)胞。研究人員發(fā)現(xiàn),當(dāng)aPD-1抗體結(jié)合到PD-1+細(xì)胞時(shí),遮蓋著的IL-15的活性完全恢復(fù)。一般情況下,IL-15的毒性和抗腫瘤活性都依賴(lài)IL-15本身的活性,因而常常是伴生的,一榮俱榮,一損俱損。研究人員提出的新的改造策略,將IL-15的毒性和抗腫瘤活性有效地在空間上分割開(kāi),以物理遮蓋形成空間位阻的方法降低IL-15的活性進(jìn)而降低在外周組織的毒性,以PD-1輔助靶向和輔助結(jié)合的方式特異性地恢復(fù)IL-15在瘤內(nèi)PD-1+CD8+T細(xì)胞上的活性進(jìn)而有效地發(fā)揮抗腫瘤功能。
受限于有限的融合蛋白結(jié)構(gòu)信息,遮蓋的IL-15重新獲得活性的機(jī)制尚不清楚。研究人員也提出兩種假設(shè),一種是在aPD-1抗體結(jié)合到細(xì)胞上PD-1分子時(shí),F(xiàn)c與IL-15之間的結(jié)構(gòu)發(fā)生構(gòu)象改變,使原先遮蓋的IL-15不再被遮蓋,IL-15的活性完全釋放。另一種是aPD-1抗體將IL-15錨定在細(xì)胞表面,提升融合蛋白的局部濃度,增強(qiáng)IL-15與受體的結(jié)合概率,活性因而得到大幅恢復(fù)。改造的aPD-1-IL-15融合蛋白在多種小鼠腫瘤模型中展現(xiàn)出顯著抑制腫瘤生長(zhǎng)的能力,并且完全不會(huì)產(chǎn)生毒副作用。機(jī)制上,腫瘤內(nèi)預(yù)先存在的CD8+T細(xì)胞是融合蛋白發(fā)揮抗腫瘤功能的主要效應(yīng)細(xì)胞,融合蛋白能夠顯著促進(jìn)CD8+T細(xì)胞的增殖、增強(qiáng)CD8+T細(xì)胞的效應(yīng)能力,不僅能夠抑制原位腫瘤的生長(zhǎng),還能抑制腫瘤的遠(yuǎn)端轉(zhuǎn)移,并提供長(zhǎng)久的機(jī)體免疫記憶保護(hù)。
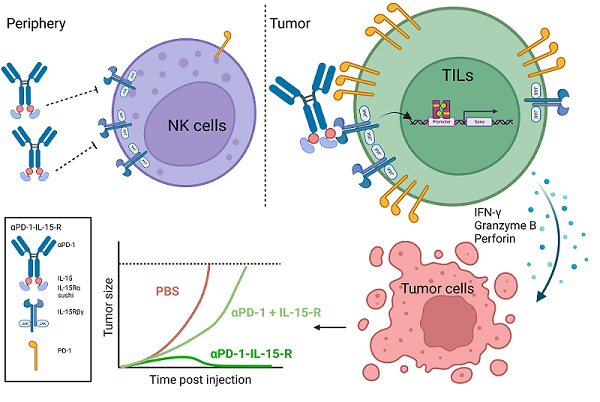
Anti-PD-1-IL-15-R通過(guò)PD-1順式遞送IL-15-R,特異性地結(jié)合并激活腫瘤內(nèi)PD-1+CD8+T細(xì)胞發(fā)揮抗腫瘤功能的模式圖
中國(guó)科學(xué)院生物物理研究所的博士生申姣和鄒壯志是本論文的共同第一作者;清華大學(xué)醫(yī)學(xué)院的傅陽(yáng)心教授和中國(guó)科學(xué)院生物物理研究所的彭華研究員是本論文的共同通訊作者。該研究得到國(guó)家科技重大專(zhuān)項(xiàng)的資助。生物物理所實(shí)驗(yàn)動(dòng)物平臺(tái)為該研究提供了重要的技術(shù)支持。
原始出處:
Jiao Shen, et al. An engineered concealed IL-15-R elicits tumor-specific CD8+T cell responses through PD-1-cis delivery. J Exp Med (2022) 219 (12): e20220745.


