以丘腦底核(Subthalamic nucleus, STN)為靶點(diǎn)的腦科高頻深部腦刺激(Deep brain stimulation, DBS)是一種治療中晚期帕金森病(Parkinson's disease, PD)的有效手段。然而,學(xué)轉(zhuǎn)DBS的化研具體作用機(jī)制是什么、為什么高頻刺激才有療效等關(guān)鍵科學(xué)問(wèn)題尚未闡明。究院經(jīng)機(jī)深入研究DBS的舒友生團(tuán)示深森病神經(jīng)機(jī)制將為優(yōu)化DBS刺激模式與參數(shù)、提升臨床療效提供重要理論依據(jù)。隊(duì)揭的神

2025年4月19日,部腦復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院舒友生課題組在《自然-通訊》(Nature Communications)上發(fā)表了題為“Deep brain stimulation alleviates Parkinsonian motor deficits through desynchronizing GABA release in mice”的刺激研究論文。該研究首次揭示了GABA遞質(zhì)的治療制非同步化釋放(Asynchronous release, AR)模式在高頻DBS治療中的關(guān)鍵作用,從細(xì)胞、帕金突觸及神經(jīng)環(huán)路層面系統(tǒng)解析了STN-DBS的腦科神經(jīng)機(jī)制,為優(yōu)化帕金森病臨床治療提供了新方向。學(xué)轉(zhuǎn)

研究表明,化研帕金森病患者的究院經(jīng)機(jī)丘腦底核常出現(xiàn)異常同步化的神經(jīng)電活動(dòng),而通過(guò)植入電極進(jìn)行高頻脈沖電刺激(通常高于100 Hz)可顯著抑制神經(jīng)網(wǎng)絡(luò)電活動(dòng)的舒友生團(tuán)示深森病同步性,改善運(yùn)動(dòng)功能障礙。舒友生團(tuán)隊(duì)的前期研究發(fā)現(xiàn),大腦皮層中特殊的突觸傳遞模式AR具有對(duì)動(dòng)作電位發(fā)放時(shí)間精確性的調(diào)控作用,即去同步化(Desynchronize)神經(jīng)元電活動(dòng)(Neuron 2020,Cerebral Cortex 2021)。基于AR強(qiáng)度與DBS療效均呈現(xiàn)類似的頻率依賴特征,即都需要高頻刺激。因此,該團(tuán)隊(duì)提出科學(xué)假設(shè):高頻STN-DBS過(guò)程中可能導(dǎo)致神經(jīng)遞質(zhì)的AR,去同步化PD病理?xiàng)l件下STN神經(jīng)元的電活動(dòng)與異常同步的網(wǎng)絡(luò)活動(dòng),從而實(shí)現(xiàn)臨床療效。
在多巴胺耗竭的PD小鼠模型上,利用離體腦片電生理記錄技術(shù)對(duì)STN神經(jīng)元進(jìn)行電活動(dòng)檢測(cè),發(fā)現(xiàn)臨床常用的130 Hz高頻電刺激可顯著誘發(fā)神經(jīng)遞質(zhì)γ-氨基丁酸(GABA)和谷氨酸的強(qiáng)烈AR,初期短暫抑制STN神經(jīng)元后,隨即去同步化其電活動(dòng)。相比之下,如果給予臨床上無(wú)療效且加重癥狀的20 Hz低頻電刺激,僅檢測(cè)到非常微弱的AR,且不影響STN神經(jīng)元的電活動(dòng)。進(jìn)一步的藥理學(xué)實(shí)驗(yàn)顯示,STN-DBS的運(yùn)動(dòng)改善效應(yīng)由GABA能抑制性突觸傳遞所介導(dǎo),表明GABA的釋放在此過(guò)程中起到主導(dǎo)作用。
進(jìn)一步結(jié)合在體電生理記錄、光遺傳學(xué)等技術(shù),研究發(fā)現(xiàn)STN上游核團(tuán)外側(cè)蒼白球(Globus pallidus externa, GPe)的GABA能抑制性突觸輸入在STN-DBS中至關(guān)重要。在STN進(jìn)行的高頻DBS通過(guò)誘導(dǎo)來(lái)源于GPe小清蛋白(PV)陽(yáng)性神經(jīng)元軸突上GABA的非同步化釋放,去同步化STN神經(jīng)元電活動(dòng),抑制局部場(chǎng)電位中的低頻β振蕩,從而緩解PD小鼠模型的運(yùn)動(dòng)功能障礙。但是,特異性激活非PV神經(jīng)元軸突則不能起到類似的效應(yīng)。結(jié)合特異性凋亡的實(shí)驗(yàn)進(jìn)一步證明,PV神經(jīng)元軸突的特異性激活是STN-DBS發(fā)揮療效的充分和必要條件。
最后,研究團(tuán)隊(duì)通過(guò)特異性調(diào)控AR強(qiáng)度驗(yàn)證其在DBS療效中的作用。在STN局部給予慢鈣螯合劑EGTA-AM顯著降低AR強(qiáng)度,阻斷了高頻STN-DBS的運(yùn)動(dòng)功能改善效果;而通過(guò)RNA干擾技術(shù)特異性敲降GPe中PV神經(jīng)元的鈣感受器蛋白Synaptotagmin-1的表達(dá),可顯著增強(qiáng)20 Hz低頻刺激誘導(dǎo)的AR強(qiáng)度,使低頻DBS也能改善運(yùn)動(dòng)功能。這些結(jié)果表明,AR強(qiáng)度是優(yōu)化STN-DBS刺激模式和參數(shù)的重要生物標(biāo)志物。該研究首次從突觸釋放模式——非同步化遞質(zhì)釋放的新視角,闡釋了高頻DBS治療帕金森病的細(xì)胞、突觸和環(huán)路機(jī)制(圖1),或?qū)⑼苿?dòng)帕金森病治療從經(jīng)驗(yàn)性參數(shù)調(diào)整向基于AR生物標(biāo)志物的精準(zhǔn)神經(jīng)調(diào)控范式的轉(zhuǎn)變。
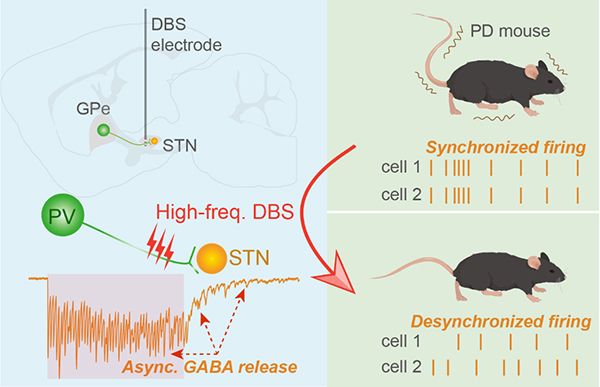
圖:丘腦底核高頻DBS治療帕金森病的神經(jīng)機(jī)制。高頻電刺激導(dǎo)致PV神經(jīng)元軸突上的GABA非同步化釋放,從而去同步化STN神經(jīng)元的電活動(dòng),實(shí)現(xiàn)對(duì)運(yùn)動(dòng)癥狀的治療作用。
復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院舒友生教授和中南大學(xué)生命科學(xué)學(xué)院鄧穗馨助理教授為該論文的通訊作者。復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院博士生徐宗藝為第一作者,博士生段威和苑書語(yǔ)做出了重要貢獻(xiàn)。復(fù)旦大學(xué)華山醫(yī)院郁金泰教授和王堅(jiān)教授、復(fù)旦大學(xué)上海數(shù)學(xué)與交叉學(xué)科研究所尤翀副教授、中南大學(xué)生命科學(xué)學(xué)院李家大教授對(duì)該研究提供了大力支持和幫助。研究得到了國(guó)家自然科學(xué)基金、科技創(chuàng)新2030-重大項(xiàng)目、上海市優(yōu)秀學(xué)術(shù)/技術(shù)帶頭人項(xiàng)目、湖南省自然科學(xué)基金、長(zhǎng)沙市自然科學(xué)基金的資助。
原文鏈接:https://www.nature.com/articles/s41467-025-59113-6
制圖:實(shí)習(xí)編輯:責(zé)任編輯:孫芯蕓


